Daftar Isi
A. Pengertian Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat yang bergantung pada konsentrasi molekul atau ion zat terlarut, tetapi tidak bergantung pada jenis zat terlarutnya.
Sifat koligatif meliputi empat hal yaitu:
- Penurunan Tekanan Uap
- Penurunan Titik Beku
- Kenaikan Titik Didih
- Tekanan Osmotik
[inline_ads]
B. Pengertian Larutan Non-Elektrolit dan Elektrolit
Larutan elektrolit adalah larutan yang zat terlarutnya terionisasi. Maka dari itu, larutan elektrolit dapat mengahantarkan arus listrik dengan.
Sedangkan larutan non-elektrolit adalah larutan yang zat terlarutnya tidak terionisasi. Maka dari itu, larutan elektrolit tidak dapat menghantarkan listrik.
Perhitungan sifat koligatif pada larutan non-elektrolit dan elektrolit sedikit berbeda. Perhitungan sifat koligatif pada larutan elektrolit dikalikan dengan faktor Van’t Hoff. Rumusnya yaitu:
\begin{aligned}
i&=1+(n-1)\alpha\\
α&=\frac{jumlah \space mol \space zat \space yang \space terionisasi}{jumlah \space mol \space zat \space yang \space dilarutkan}
\end{aligned}Ket:
i = faktor Van’t Hoff
n = jumlah ion elektrolit
α = derajat ionisasi/disosiasi
Jika α = 1 maka larutan ini disebut larutan elektrolit kuat. Pada elektrolit kuat, rumusnya menjadi sebagai berikut.
i=n
Ket:
i = faktor Van’t Hoff
n = jumlah ion elektrolit
[inline_ads]
C. Sifat Koligatif Larutan
1. Penurunan Tekanan Uap (ΔP)

Copyright: Chemguide
Saat air diletakkan dalam suatu wadah tertutup, terjadi perubahan partikel air dari fase cair ke fase gas (uap). Saat gas di dalam wadah tersebut mencapai tekanan tertentu, akan ada partikel fase gas yang berubah menjadi fase cair kembali.
Tekanan uap adalah tekanan oleh gas di atas cairan dalam wadah tertutup.
Tekanan uap jenuh adalah tekanan oleh gas di atas cairan dalam wadah tertutup saat terjadi kesetimbangan termodinamis antara fase cair dan gas. Penambahan zat terlarut mengakibatkan menurunnya tekanan uap. Sederhananya, hal ini terjadi karena semakin banyak partikel zat terlarut, maka partikel air akan lebih sulit untuk bergerak dan berubah fase menjadi gas.
a) Rumus non-Elektrolit
Rumus tekanan uap jenuh dan penurunan tekanan uap jenuh larutan non-elektrolit:
\begin{aligned}
\Delta P&=P°-P\\
\Delta P&=P°\times X_A\\
P&=P°\times X_{B} \\
\\
X_A &= \frac{n_A}{n_A+n_B}\\
X_B &= \frac{n_B}{n_A+n_B}\\
\end{aligned}Ket:
ΔP = penurunan tekanan uap jenuh larutan (cmHg)
P = tekanan uap jenuh larutan (cmHg)
P° = tekanan uap jenuh pelarut murni/tanpa zat terlarut (cmHg)
XA = fraksi mol zat terlarut
XB = fraksi mol zat pelarut
nA = jumlah mol zat terlarut
nB = jumlah mol zat pelarut
b) Rumus Elektrolit
Rumus tekanan uap jenuh dan penurunan tekanan uap jenuh larutan elektrolit:
\begin{aligned}
\Delta P&=X_A\times P°\\
\\
X_A &= \frac{n_A \times i}{n_B+n_A\times i}\\
X_A&=\frac{n_A \times (1+(n-1)\alpha)}{n_B+n_A \times (1+(n-1)\alpha)}
\end{aligned}Ket:
ΔP = penurunan tekanan uap jenuh larutan (cmHg)
P° = tekanan uap jenuh pelarut murni/tanpa zat terlarut (cmHg)
i = faktor Van’t Hoff
XA = fraksi mol zat terlarut
XB = fraksi mol zat pelarut
nA = jumlah mol zat terlarut
nB = jumlah mol zat pelarut
n = jumlah ion elektrolit
α = derajat ionisasi/disosiasi
2. Penurunan Titik Beku (ΔTf)
Sederhananya seperti ini. Saat zat pelarut (misalnya air) didinginkan hingga beku, partikel pelarut tersebut akan membentuk kristal tertentu. Saat ditambahkan zat terlarut, zat terlarut tersebut akan mengganggu (‘menghalangi’) pembentukan kristal tersebut sehingga perlu suhu yang lebih rendah agak benar-benar beku.
a) Rumus non-Elektrolit
\begin{aligned}
\Delta T_f&=m \times K_f\\
\Delta T_f&=T_{f pelarut}-T_{flarutan}
\end{aligned}Ket:
ΔTf = perubahan titik beku larutan (°C)
m = molalitas (m)
Kf = tetapan penurunan titik beku molal (°C m-1)
Tfpelarut = titik beku pelarut (tanpa zat terlarut) (°C)
Tflarutan = titik beku larutan (°C)
b) Rumus Elektrolit
\begin{aligned}
\Delta T_f&=m \times K_f \times i\\
\Delta T_f&=m \times K_f \times (i+(n-1) \alpha)\\
\end{aligned}Ket:
ΔTf = penurunan titik beku larutan (°C)
m = molalitas (m)
Kf = tetapan penurunan titik beku molal (°C m-1)
n = jumlah ion elektrolit
α = derajat ionisasi/disosiasi
3. Kenaikan Titik Didih (ΔTb)
Sederhananya seperti ini. Saat zat pelarut (misalnya air) dipanaskan hingga menguap, partikel pelarut tersebut bergerak sangat cepat hingga berubah menjadi face gas. Saat ditambahkan zat terlarut, zat terlarut tersebut akan mengganggu (‘menghalangi’) gerakan partikel pelarut sehingga menjadi lebih sulit untuk berubah dari face cair ke fase gas.
a) Rumus non-Elektrolit
\begin{aligned}
\Delta T_b&=m \times K_b\\
\Delta T_b&=T_{b pelarut}-T_{b larutan}
\end{aligned}Ket:
ΔTb = perubahan titik didih larutan (°C)
m = molalitas (m)
Kf = tetapan penurunan titik beku molal (°C m-1)
Tbpelarut = titik didih pelarut (tanpa zat terlarut) (°C)
Tfbarutan = titik didih larutan (°C)
b) Rumus Elektrolit
\begin{aligned}
\Delta T_b&=m \times K_b \times i\\
\Delta T_b&=m \times K_b \times (i+(n-1) \alpha)\\
\end{aligned}Ket:
ΔTb = penurunan titik didih larutan (°C)
m = molalitas (m)
Kb = tetapan penurunan titik didih molal (°C m-1)
n = jumlah ion elektrolit
α = derajat ionisasi/disosiasi
4. Tekanan Osmotik
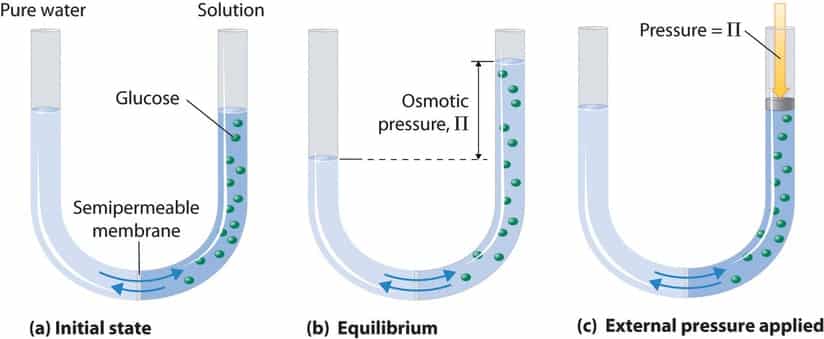
Pada bejana berhubungan, Tekanan osmotik adalah tekanan yang dibutuhkan untuk mencegah agar tinggi permukaan larutan sama dengan tinggi permukaan air murni.
a) Rumus non-Elektrolit
\begin{aligned}
\pi V &= n \times R \times T\\
\pi &= \frac{n}{V} \times R \times T\\
\pi &= M \times R \times T
\end{aligned}Ket:
π = tekanan osmotik (atm)
V = volume larutan (L)
n = jumlah mol zat terlarut
M = molaritas (M)
R = tetapan gas (0,082 L.atm.mol-1K-1)
T = suhu mutlak (K)
a) Rumus Elektrolit
\begin{aligned}
\pi V &= n \times R \times T \times i\\
\pi &= \frac{n}{V} \times R \times T \times i\\
\pi &= M \times R \times T \times i\\
\pi &= M \times R \times T \times (1+(n-1)\alpha)
\end{aligned}Ket:
π = tekanan osmotik (atm)
V = volume larutan (L)
n = jumlah mol zat terlarut
M = molaritas (M)
R = tetapan gas (0,082 L.atm.mol-1K-1)
T = suhu mutlak (K)
α = derajat ionisasi/disosiasi
[inline_ads]
D. Contoh Soal
1. Sebanyak 570 gram sukrosa (Mr = 342 g mol-1) dilarutkan dalam 2.000 mL air, lalu dipanaskan. Jika tetapan kenaikan titik didih molal 0,22°C m-1, pada suhu berapakah larutan tersebut mendidih?
\begin{aligned}
&Massa \space sukrosa ;= 570 \space gram\\
&M_r \space sukrosa;=342 \space g.mol^{-1}\\
&Massa \space pelarut (p);=volume \space air \times \rho_{air}=2.000 \space mL \times 1 \space g.mL^{-1}= 2.000 \space gram
\end{aligned}\begin{aligned}
\Delta T_b&=m \times K_b\\
\Delta T_b&=\frac{massa \space sukrosa}{M_r \space sukrosa}\times\frac{1.000}{\rho}\times K_b\\
\Delta T_b&=\frac{570}{342}\times \frac{1.000}{2.000}\times 0,22\\
\Delta T_b &=0,18\\
\\
T_{blarutan} &= T_{bpelarut}+\Delta T_b \\
T_{blarutan}&=100+0,18\\
T_{blarutan}&=100,18 \degree C
\end{aligned}Jadi, larutan akan mendidih pada suhu 100,18°C
2. Sebanyak 40 gram asam asetat dilarutkan dalam 200 mL air (ρ = 1 g ml-1). 70% senyawa tersebut terurai dalam air membentuk ion-ionnya. Jika tetapan penurunan titik beku air sebesar 1,86Cm-1, pada suhu berapakah larutan tersebut membeku? (Ar :C = 12 g mol-1, H = 1 g mol-1, O = 16 g mol-1)
\begin{aligned}
&M_r \space CH_3COOH=60 \space g.mol^{-1}\\
&m=40 \space g\\
&n=2\\
&\alpha=70\%=0,7\\
&\rho=200 \space mL \times 1 \space g.mL^{-1}=200 \space g
\end{aligned}\begin{aligned}
\Delta T_f&=\frac{m}{M_r}\times \frac{1.000}{200} \times K_f \times (1+(2-1) \alpha)\\
\Delta T_f&=\frac{40}{60} \times 5 \times 1,86 \times (1+(2-1)0,7)\\
\Delta T_f&=10,54\\
\\
T_f&=T_f\degree-\Delta T_f\\
T_f&=0-10,54 \degree C\\
T_f&=-10,54\degree C
\end{aligned}Jadi, larutan asam asetat tersebut membeku pada suhu -10,54°C.
Refrensi: Colligative Properties – Wikipedia
